Necesitamos tu ayuda para seguir informando
Colabora con Nuevatribuna
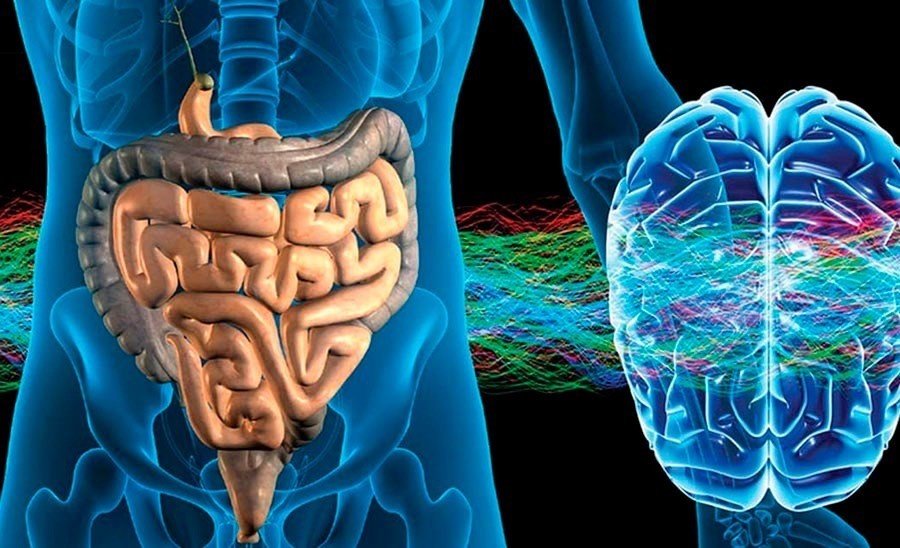
A finales del siglo XVIII, el escocés Robert Whytt afirmaba que el intestino tenía muchas terminaciones nerviosas y se hablaba de él como el “gran cerebro abdominal”. De hecho, el sistema digestivo presenta más neuronas que la espina dorsal. Por aquel entonces, ya se pensaba que muchos de los problemas de salud del cuerpo y de la mente se debían al “trastorno mental gástrico”, dando lugar a cansancio, fatiga e insomnio.
¿Qué es la tan nombrada microbiota? Es el conjunto de millones de microorganismos que viven en perfecta simbiosis en nuestro organismo, sobre todo en el tracto digestivo. Pero también existe microbiota en la boca, en la piel, en los genitales, etc. Diferentes factores como el tipo de dieta, más o menos rico en productos fermentados y probióticos, el consumo de antibióticos, el tipo de parto o el estrés entre otras, influyen en la composición de la microbiota intestinal.
Robert Whytt afirmaba que el intestino tenía muchas terminaciones nerviosas y se hablaba de él como el “gran cerebro abdominal”
En humanos, la evidencia de que existe una interacción entre la microbiota-intestino-cerebro, surgió hace más de 20 años a partir de la observación de la mejoría de síntomas en pacientes con encefalopatía hepática, después de que se les administraran antibióticos orales. Mientras tanto, ha ido surgiendo diferente evidencia científica que apoya el papel de la microbiota en la influencia de la ansiedad y de los comportamientos depresivos. Más recientemente, se ha visto cierta relación entre la disbiosis intestinal (el desequilibrio constante de la flora intestinal) y el autismo. De hecho, los pacientes con autismo presentan unas alteraciones específicas de la microbiota según la gravedad de la enfermedad.
En estudios en animales se ha encontrado que la colonización bacteriana del intestino es fundamental para el desarrollo y la maduración tanto del Sistema Nervioso entérico (SNE) como del Sistema Nervioso Central (SNC). La falta de colonización microbiana se asocia con una alteración de los neurotransmisores de ambos sistemas nerviosos. Esta alteración también se asocia con alteraciones de las funciones del sistema motor y sensorial del intestino, lo que provoca un retraso del vaciado gástrico y del tránsito intestinal.
El cerebro tiene un papel destacado en la modulación de funciones intestinales (motilidad, secreción de ácido, de bicarbonato y de moco, manejo de fluidos intestinales…). Estas funciones son esenciales en el mantenimiento de la capa mucosa dónde crecen grupos individuales de bacterias en diferentes microhábitats. Una desregulación del eje intestino-cerebro puede afectar a la microbiota intestinal a través de la perturbación del hábitat mucoso normal. y vamos en la dirección de la medicina integrativa, que permite conectar todos los órganos con las tripas y la microbiota intestinal.
El intestino es el mayor reservorio de bacterias del cuerpo. Cada vez hay más pruebas que revelan el grado de interdependencia entre los huéspedes y su microbiota intestinal, y subrayan la importancia del eje intestino-cerebro.
Los pacientes con autismo presentan unas alteraciones específicas de la microbiota según la gravedad de la enfermedad
En el Institut Pasteur, neurobiólogos de la Unidad de Percepción y Memoria (Institut Pasteur/CNRS), inmunobiólogos de la Unidad de Microambiente e Inmunidad (Institut Pasteur/Inserm) y microbiólogos de la Unidad de Biología y Genética de la Pared Celular Bacteriana (Institut Pasteur/CNRS/Inserm) han compartido su experiencia para investigar cómo las bacterias en el intestino controlan directamente la actividad de determinadas neuronas en el cerebro.
Los científicos se centraron en el receptor NOD2 (dominio de oligomerización de nucleótidos), que se encuentra en el interior de la mayoría de las células inmunitarias. Este receptor detecta la presencia de muropéptidos, que son los componentes básicos de la pared celular bacteriana. Además, se ha establecido previamente que las variantes del gen que codifica para el receptor NOD2 se asocian con trastornos digestivos, incluida la enfermedad de Crohn, así como con enfermedades neurológicas y trastornos del estado de ánimo.
Sin embargo, estos datos fueron insuficientes para demostrar una relación directa entre la actividad neuronal en el cerebro y la actividad bacteriana en el intestino. Así lo reveló el consorcio de científicos en el nuevo estudio.
Utilizando técnicas de imagen cerebral, los científicos observaron inicialmente que el receptor NOD2 en ratones es expresado por neuronas en diferentes regiones del cerebro y, en particular, en una región conocida como hipotálamo. Posteriormente descubrieron que la actividad eléctrica de estas neuronas se suprime cuando entran en contacto con los muropéptidos bacterianos del intestino.
Cada vez hay más pruebas que revelan el grado de interdependencia entre los huéspedes y su microbiota intestinal, y subrayan la importancia del eje intestino-cerebro
"Los muropéptidos en el intestino, la sangre y el cerebro se consideran marcadores de proliferación bacteriana", explica Ivo G. Boneca, jefe de Biología y Genética de la Unidad de Pared Celular Bacteriana del Instituto Pasteur (CNRS/Inserm).
Por el contrario, si el receptor NOD2 está ausente, estas neuronas ya no son suprimidas por los muropéptidos. En consecuencia, el cerebro pierde el control de la ingesta de alimentos y la temperatura corporal. Los ratones aumentan de peso y son más susceptibles a desarrollar diabetes tipo 2, particularmente en las hembras mayores.
Es extraordinario descubrir que los fragmentos bacterianos actúan directamente sobre un centro cerebral tan estratégico como el hipotálamo, sin mediadores, que se sabe que gestiona funciones vitales como la temperatura corporal, la reproducción, el hambre y la sed", comenta Pierre-Marie Lledo, científico del CNRS y jefe de la Unidad de Percepción y Memoria del Instituto Pasteur.
De este modo, las neuronas parecen detectar la actividad bacteriana (proliferación y muerte) como un indicador directo del impacto de la ingesta de alimentos en el ecosistema intestinal.
El impacto de los muropepéptidos en las neuronas hipotalámicas y el metabolismo plantea preguntas sobre su papel potencial en otras funciones cerebrales, y puede ayudarnos a comprender el vínculo entre ciertas enfermedades cerebrales y las variantes genéticas de NOD2.
Este descubrimiento allana el camino para nuevos proyectos interdisciplinarios en la frontera entre las neurociencias, la inmunología y la microbiología y, en última instancia, para nuevos enfoques terapéuticos para enfermedades cerebrales y trastornos metabólicos como la diabetes o la obesidad, entre otros.
Por último, compartir esta reflexión de Victor Hugo: “En el hombre hay una serpiente: el intestino, que tienta, traiciona y castiga”.








![Imagen de un títere[1] generada con el programa de DEEP AI, INC](/asset/thumbnail,768,432,center,center/media/nuevatribuna/images/2024/07/21/2024072107062137789.jpg)





